腫瘍溶解性ウイルスの能力を解き放つ:最大の効果を得るためのデザイン
キーワード: 腫瘍溶解性ウイルス, 腫瘍ターゲティング, 免疫刺激
将来性のあるがん治療法である腫瘍溶解性ウイルスは、ウイルス特有の性質を活用して、がん細胞に特異的に感染して細胞を溶解することで免疫システムを活性化します。腫瘍細胞と正常細胞共に毒性のある従来の化学療法とは異なり、正常な細胞を保護しながら腫瘍微小環境(TEM)内で増殖できるように遺伝的に改変されたウイルスを活用することで、より腫瘍ターゲティング能力の高いアプローチを実現しています。腫瘍溶解性ウイルスの研究には、ワクシニアウイルス(VACV), 単純ヘルペスウイルス(HSV), アデノウイルス and 水疱性口内炎ウイルス(VSV)など、多くのウイルスが利用されています。本稿では、有望な腫瘍溶解性ウイルスのうち2種類(VACVとHSV)の重要な特性に注目し、治療効率の向上のために使われているデザインについて掘り下げていきます。
強力な腫瘍溶解性ウイルスを作るための鍵は、ウイルスの生存率、腫瘍ターゲティング特異性、抗腫瘍応答刺激を高めるように最適化されたデザインを持つようにゲノム編集された高溶解性ウイルスを選ぶことです。
強力な腫瘍溶解性ウイルスデザインへ移動
効果的な腫瘍溶解ウイルス製剤に必要なもの
腫瘍溶解性ウイルスを治療薬として評価するためは、ウイルスの感染指向性、溶解性、安全性などが考慮されます。数多くの様々な溶解性ウイルス研究があるにもかかわらず、HSV-1などの一握りの溶解性ウイルスだけが臨床用途に認可されています。 HSV はいくつかの重要な特性によって、がん治療用腫瘍溶解性ウイルスとして最も利用されています。HSVは多くの細胞タイプに感染することができ、がん細胞にHSV受容体(nectin-1、ヘルペスウイルス侵入メディエーター)を過剰発現させることでがん細胞に自然な感染指向性を示します。感染後には、ライフサイクルの短いHSVは細胞の溶解と近隣細胞への感染を繰り返すことで、がん細胞集団内を迅速に伝播することができます。野生型HSVはヒトに対して病原性を持ちますが、正常細胞内での複製を阻害するようなゲノム改変によって弱毒化することや、抗ウイルス治療によって安全性を高めることができます。
HSV-1は臨床で成功を収めている一方で、VACVは腫瘍溶解性ウイルス製剤としてHSVよりも明らかな利点を持ちます(表1)が、今のところ臨床使用への認可がされた事例はありません。HSVと同様に、VACVもがん細胞にウイルス複製を促進するタンパク質(特に上皮成長因子受容体(EGFR))を過剰発現することで自然な感染指向性を示します。VACVは受容体の介在なしで宿主細胞膜とウイルス脂質膜の融合による直接的な細胞内への侵入が可能なために、HSVよりも幅広い細胞種への感染指向性を持ちます。VACVはHSVと同様に細胞溶解によって腫瘍全体に伝播することが可能です。VACVは天然痘ワクチンとして臨床使用されているために、徹底的な研究とデータの蓄積によって確認された良好な安全性プロファイルを示しています。現在のVACV株は溶解能を高めるように定性進化し(Western Reserve株は高い腫瘍溶解能を持つ)、HSVの様にゲノムの編集により正常細胞内での複製が制限されています。
VACVがHSV-1よりも優れている点としては、宿主の免疫反応によるクリアランスへの耐性が強いことです。宿主の免疫応答によって排除される可能性が高いHSVと比較して、臨床でVACVを静脈内投与しても高い有効性を維持できるために非常に優れた特性と言えます。TVECなどのHSVベースの医薬品は腫瘍への直接注入によって投与される必要があるために、複雑で侵襲的な手術が必要となり、感染リスクの上昇を招きます。その為に現在のHSVベースの医薬品は、アクセスの簡単な腫瘍(肉腫や黒色腫など)に限定されますが、VACVはアクセスが困難な腫瘍(膵臓がんや肝臓がんなど)や転移した腫瘍を標的とすることが可能になります。腫瘍溶解性HSVの静脈内注射には課題がありますが、最近の 第1相臨床試験 によって、HSVベース医薬品の静脈内投与にも将来的に大きな可能性があることが示されています。
| VACV | HSV | |
|---|---|---|
| 承認済み医療用腫瘍溶解性ウイルス | × | TVEC, DELYTACT |
| 広い感染指向性 | ✓ | ✓ |
| 免疫応答によるクリアランスへの耐性 | ✓ | × |
| 主な投与ルート | 腫瘍内投与+静脈内投与 | 腫瘍内投与 |
| 全体的な安全性 | ✓ | ✓ |
表1.腫瘍溶解性ウイルス療法におけるVACVとHSVの比較。緑色でハイライトされたボックスはそれぞれのカテゴリーで優位であることを示す。
強力な腫瘍溶解性ウイルスをデザインする
腫瘍溶解性ウイルスのデザインを計画されるのでしたら、エンジニアリングするウイルスとしてVACVかHSVをお勧めします。どちらの組み換えウイルスも遺伝的改変に適しているために、腫瘍溶解医薬品としての効能と安全性を高めることができます。利点として、VACVとHSVはゲノムサイズが190kbと150kbと巨大であるために大きなサイズの遺伝配列を挿入することができます。しかしながら、このサイズのゲノムの改変およびクローニングを行うことには困難が伴います。通常のプラスミドは使用できませんので、bacterial artificial chromosome (BAC)とyeast artificial chromosome (YAC)を利用したクローニングを行います。BACYACはBACとYACの主要な要素を組み合わされており、大腸菌と酵母の両方で増幅と遺伝改変が可能になります。戦略的にBACYACをデザインすることで、腫瘍細胞へのターゲティング特異性や腫瘍溶解能の向上と安全プロファイルの増強を達成することが可能となり、がん治療法としての効能を大きく向上させることができます
ターゲティング特異性の向上
臨床における効果を高めるために、腫瘍溶解性ウイルスのがん細胞への特異性を高め、かつオフターゲットによる副作用を避けるために、一般的にターゲット配列の挿入や特定の変異を導入することが行われます(図1)。ウイルスゲノムの改変と治療用遺伝子の発現と組み合わせることによって、がん細胞への特異的な感染と溶解が実現できます。ウイルスのがん受容体への結合能の増強と正常細胞への結合能を減少させるための配列や変異を導入することでがん細胞への特異性を向上させます。腫瘍溶解性HSVでは、糖タンパク質Dの内在性受容体結合ドメインに抗HER2抗体を発現することで、HER2を過剰発現している腫瘍細胞(乳がん、卵巣がん、膠芽腫がんなど)への特異性を高めています。
ウイルスの効率的な複製に必須で、がん細胞で特異的に過剰発現しているタンパク質をコードする遺伝子をウイルスゲノムから削除することでウイルスががん細胞内で限定的に複製するようになります。例えば、VACVベースの医薬品JX-594では、DNA代謝に必須の遺伝子(チミジンキナーゼ)をウイルスゲノムから欠損させています。チミジンキナーゼが過剰発現しているがん細胞でのみ宿主細胞のチミジンキナーゼがウイルス由来のチミジンキナーゼの欠損を補完することができます。HSVベースの医薬品をデザインする際には、ウイルスが抗ウイルス核酸アナログ医薬品のganciclovirやacyclovirへの感受性を持つことを担保するためにチミジンキナーゼは維持することをお勧めします。ウイルスゲノムの複製に必須のウイルス遺伝子ICP6に変異を導入することで、正常細胞におけるウイルス複製を弱めることが可能です。増殖能を持つがん細胞ではウイルスICP6の欠失を補完できるために、ウイルスの複製は可能になります。
腫瘍溶解性ウイルスの複製をより効果的にするアプローチとして、宿主の免疫反応を回避しつつ、宿主免疫と翻訳シャットダウンが起こらないTMEのみで限定的にウイルス複製を可能する方法が挙げられます。腫瘍溶解性HSVベース医薬品にはγ34.5遺伝子に変異が導入されています。γ34.5タンパク質は翻訳開始を阻害して、ウイルスの宿主のIFN応答への耐性獲得に重要な役目をもちます。γ34.5の変異は、ウイルスの免疫回避能と宿主の転写シャットダウンへの耐性を破壊し、TME以外の正常細胞におけるウイルスの複製を弱めます。
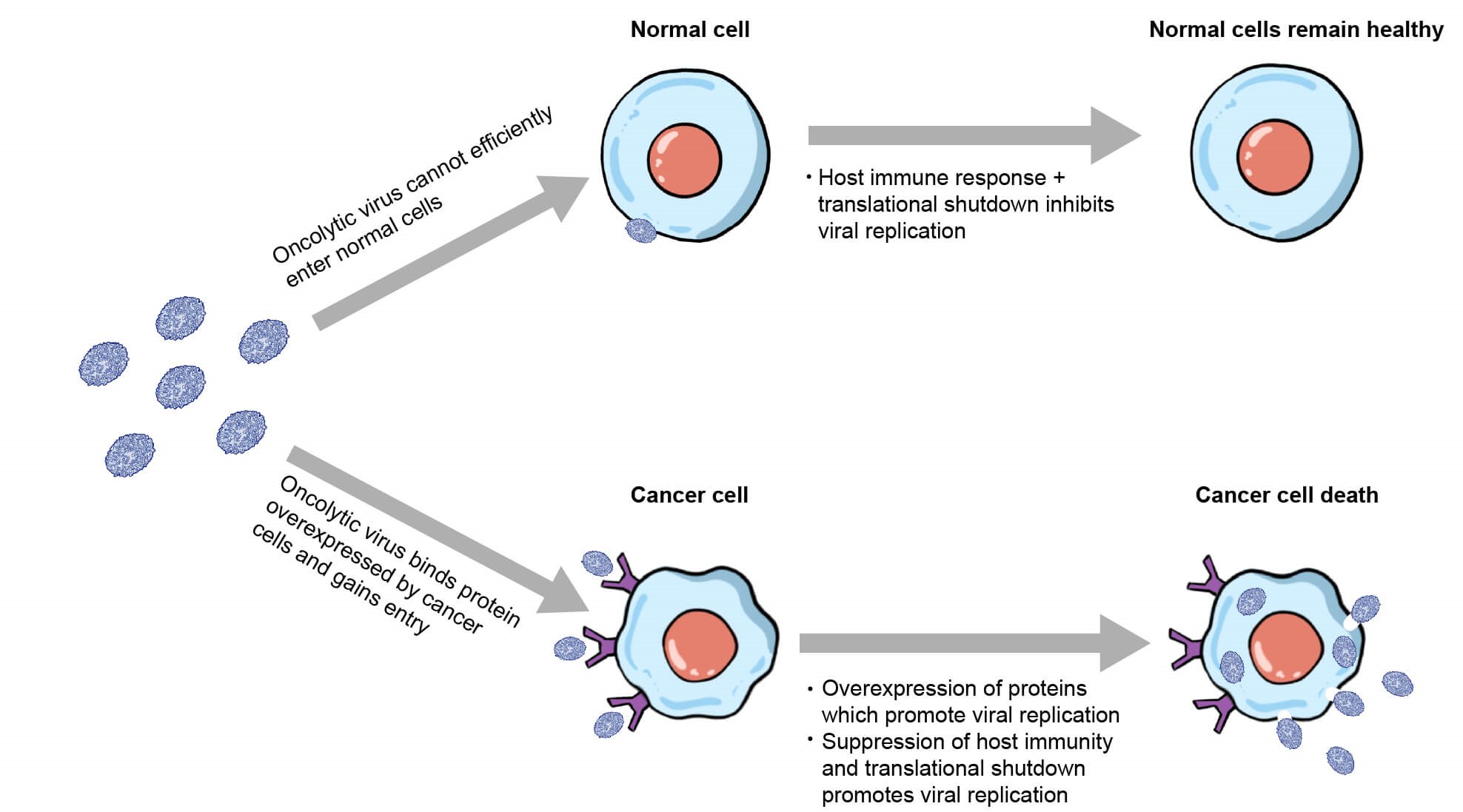
図 1. がん細胞に対する親和性が強化された腫瘍溶解性ウイルスの模式図。
腫瘍破壊効果の向上:抗血管新生効果
腫瘍溶解性ウイルスをデザインする際に考慮すべき別の事項は、ウイルスによる腫瘍破壊効果を向上させる方法です。腫瘍溶解性ウイルスの複製による直接的な結果としてがん細胞死が発生します。しかし、ウイルス感染による間接的な効果も腫瘍破壊に関与していることを利用して、治療効果を増進させることが可能であり、血管新生や免疫反応に影響を与える治療用遺伝子をBACYACバックボーンに組み込むことで可能になります。
血管新生はがんの生存と増殖に重要であり、血管新生を阻害することでがんへの栄養分の提供をカットして飢餓状態をもたらすことができます。VACVベースのJX-594はがん周辺の血管内皮細胞に感染して、内皮細胞の損傷、血栓の形成、好中球のリクルートなどによって血管の虚脱を引き起こします(図2)。腫瘍溶解性ウイルスをデザインする際には、抗血管新生効果をさらに向上させる遺伝子を組み込んで、より効果的な腫瘍の破壊をもたらす戦略を考慮するべきです。1つのアプローチとしては、血管新生を促進する宿主因子である上皮成長因子受容体(EGFR)や血管内皮増殖因子(VEGF)を標的とすることが挙げられます。組み換えウイルスからEGFRやVEGFに対する抗体をコードする遺伝子を発現するなどによって達成できます。この方法は腫瘍溶解性VACVにおいて機能することが証明され、リガンド‐受容体の結合を阻害することでマウスの治療効果の向上することが確認されています。
腫瘍溶解性ウイルスによる抗血管新生効果の向上させる戦略は効果的ですが、がん破壊とウイルスの伝播の間のバランスをうまくとる必要があります。血流を破壊することでウイルスが別のがん部位への伝播することも制限されることや、化学療法における抗がん剤の投与にも影響を及ぼす可能性があります。こういったことも、腫瘍溶解性ウイルスの設計の初期に治療薬としての有効性を確保するために考慮する必要があります。
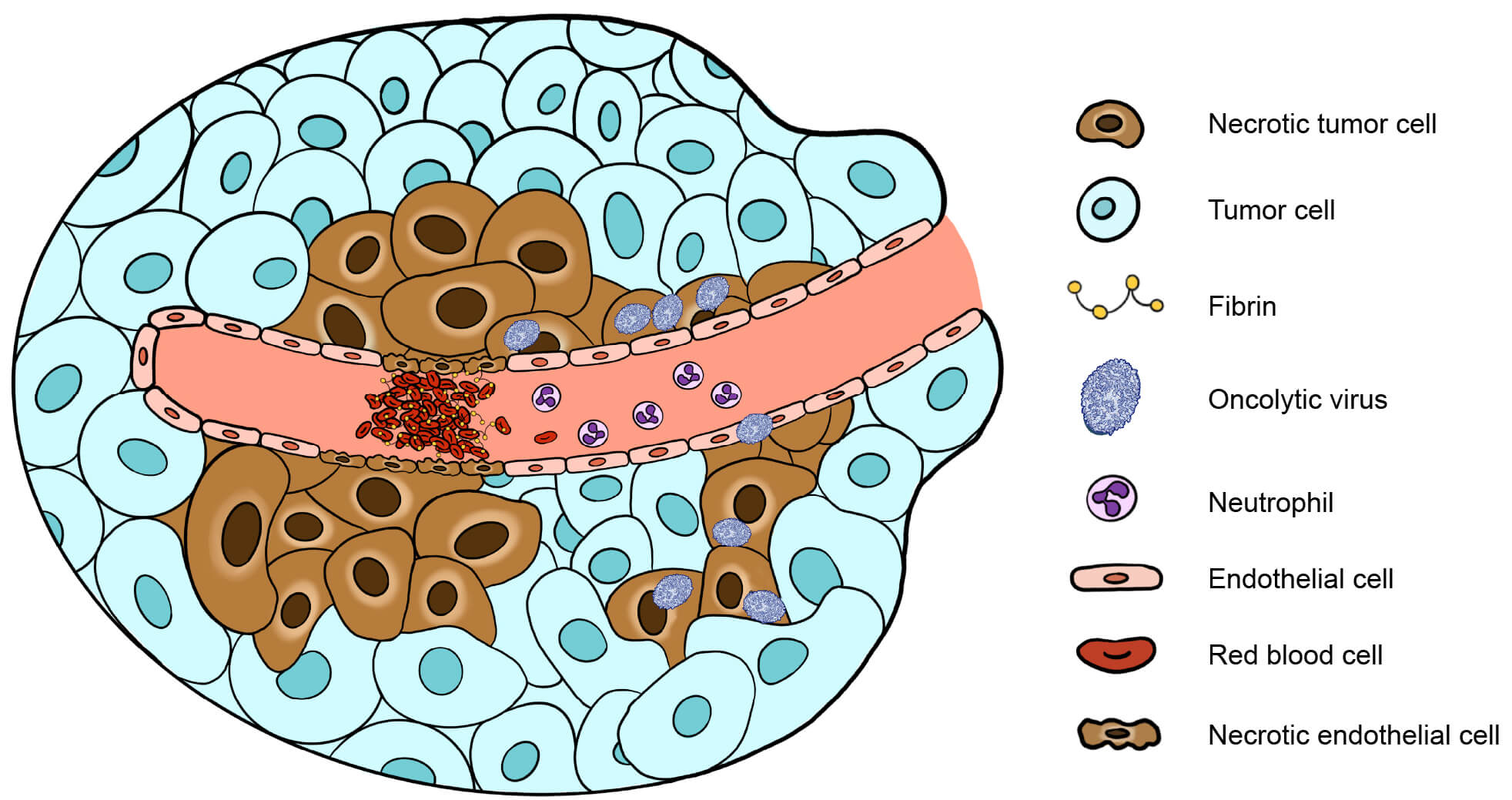
図 2. 腫瘍における腫瘍溶解性ウイルスの抗血管新生作用の誘導メカニズム。
腫瘍破壊効果の向上:抗腫瘍免疫
腫瘍破壊をもたらす腫瘍溶解性ウイルスをデザインする際には、TMEでの免疫抑制を克服して抗腫瘍免疫反応を引き起こすタンパク質を過剰発現させることは有効なアプローチです。腫瘍部位で免疫細胞、炎症誘発性サイトカインおよびケモカインを増やすことや、免疫チェックポイント阻害剤やCAR-Tなどの養子細胞移植療法を使用した免疫療法を成功させるための腫瘍プライミングを行うことは、臨床環境で長期的な抗腫瘍効果を得るためには非常に効果的となります。
ウイルスゲノムに炎症誘発性サイトカインをコードする遺伝子を挿入することで、通常は免疫系が疲労しているTMEに免疫細胞を誘導することができます。HSVベースのTVECやVACVベースのJX-594は、炎症誘発性サイトカインをコードするGM-CSFを持つように改変することによって抗原提示細胞の効果を高め、T細胞とNK細胞を腫瘍部位へと誘導することができます。腫瘍溶解性HSVに挿入されている別の炎症誘発性サイトカイン、IL-12では、細胞傷害性T細胞応答およびIFN-γ産生の刺激を引き起こすことができます。IL-12を発現する腫瘍溶解性HSV(M032)は、再発性膠芽腫の治療に有望であることが示されており、第1相臨床試験が始まっています。
T細胞によって認識されるタンパク質を腫瘍細胞の表面に過剰発現させるように腫瘍溶解性ウイルスを改変する方法もあります。CAR-T細胞療法は、がん細胞の表面で過剰に発現するリガンド(CD19)を認識するCARを患者のT細胞に発現するように改変して、がん細胞を攻撃させます。CAR-T細胞療法を活用して患者の免疫系を刺激してより強力な抗腫瘍免疫反応を引き起こすために、VACVを用いてがん細胞の表面にシグナル活性を欠損したCD19断片を過剰発現させることができます。同様に、VACVを用いてT細胞表面の抗原(e.g. CD3)を認識する抗体とがん細胞表面の抗原(e.g. EphA2)を認識する抗体が連結された、分泌型二重特異性T細胞誘導体(BiTE)を発現させることもできます。どちらのケースでも、T細胞を腫瘍サイトへ誘導することによって抗腫瘍免疫の全体的な増進させます。
腫瘍溶解性ウイルスのデザインには潜在的な落とし穴があり、抗腫瘍免疫反応の刺激とウイルス伝播を阻害しないことの絶妙なバランスが存在することについて留意をしてください。全身に存在する転移性のがん細胞を標的としてVACVなどの腫瘍溶解性ウイルス治療を検討する時には、特に重要となります。
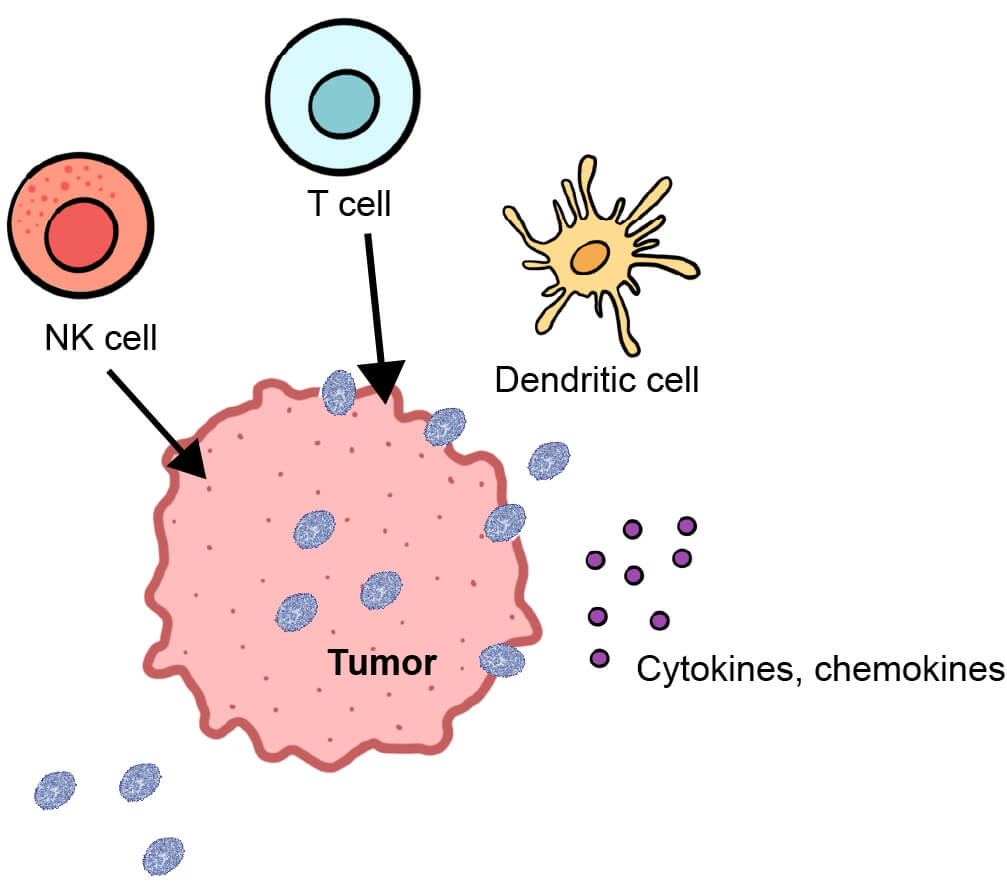
図 3. 腫瘍溶解性ウイルス感染によって引き起こされる抗腫瘍免疫
最後に
VACVやHSVはがんと闘うために非常に有効な腫瘍溶解性医薬品となります。大きなサイズのDNAを搭載できる組み換えウイルスを活用することで、ウイルスの腫瘍溶解能だけでなく腫瘍標的能、抗血管新生そして免疫反応を改変することで効能を向上させることが可能です。適切にデザインがなされた腫瘍溶解性ウイルスを創り出すことは、BACYACバックボーンに大きなDNAをクローニングすることの難しさをふくめた、多くのチャレンジがあります。ベクタービルダーは困難なクローニングを数多く手がけてきた経験があり、最高品質の正確性と効率でウイルスを製造できます。知識の蓄積とより先進的な遺伝子ツールを活用することで、より高い標的特異性と効果的な腫瘍溶解性ウイルス治療を開発できる刺激的なチャンスを手に入れることができます。
参考文献
Lin, D., Shen, Y. & Liang, T. Oncolytic virotherapy: basic principles, recent advances and future directions. Sig Transduct Target Ther 8, 156 (2023).
Zhu X, Fan C, Xiong Z, Chen M, Li Z, Tao T, Liu X. Development and application of oncolytic viruses as the nemesis of tumor cells. Front Microbiol. 2023 Jun 12;14:1188526. doi: 10.3389/fmicb.2023.1188526. PMID: 37440883; PMCID: PMC10335770.
Tang G, Wang D, Zhao X, Feng Z, Chen Q, Shen Y. The Dilemma of HSV-1 Oncolytic Virus Delivery: The Method Choice and Hurdles. Int J Mol Sci. 2023 Feb 12;24(4):3681. doi: 10.3390/ijms24043681. PMID: 36835091; PMCID: PMC9962028.
Kaufman, H., Kohlhapp, F. & Zloza, A. Oncolytic viruses: a new class of immunotherapy drugs. Nat Rev Drug Discov 14, 642–662 (2015). https://doi.org/10.1038/nrd4663
Peters C, Rabkin SD. Designing Herpes Viruses as Oncolytics. Mol Ther Oncolytics. 2015;2:15010–. doi: 10.1038/mto.2015.10. Epub 2015 Jul 22. PMID: 26462293; PMCID: PMC4599707.
Xu L, Sun H, Lemoine NR, Xuan Y, Wang P. Oncolytic vaccinia virus and cancer immunotherapy. Front Immunol. 2024 Jan 12;14:1324744. doi: 10.3389/fimmu.2023.1324744. PMID: 38283361; PMCID: PMC10811104.
Liu X, Zhao J, Li X, Lao F, Fang M. Design Strategies and Precautions for Using Vaccinia Virus in Tumor Virotherapy. Vaccines (Basel). 2022 Sep 17;10(9):1552. doi: 10.3390/vaccines10091552. PMID: 36146629; PMCID: PMC9504998.



